近日,来自麻省理工学院的zahid yaqoob团队,提出了一种新的散斑衍射断层扫描技术,实现了500nm横向分辨率和1μm轴向分辨率的生物体厚组织成像,对生物成像领域的发展具有重要意义。该文章发表在国际顶尖学术期刊《light: science & applications》,题为“mapping nanoscale topographic features in thick tissues with speckle diffraction tomography”。
研究背景
定量相位成像技术(quantitative phase imaging, qpi)被广泛用于描绘透明细胞和薄组织样本的结构与动态特性。qpi作为一种无标记成像方法,对许多生物医学研究具有重要作用。光学衍射断层扫描(optical diffraction tomography,odt)是qpi的扩展技术,可通过绘制三维折射率(refractive index,ri)图来实现生物样品的体成像。
对生物体内厚组织进行成像的能力对于许多前沿生物学研究以及临床医学应用至关重要。然而,现有的大多数qpi方法由于模型和设备的限制,仍然很大程度上局限于对细胞和薄组织切片的成像。qpi技术实现厚组织成像面临如下几个主要困难:首先,需要实现宽视场反射模式测量几何结构;其次,需要开发一个综合逆散射模型来描述较厚的非均匀介质的反向散射场的时间色散和空间像差; 第三,需要抑制多重散射背景以隔离源自特定深层的信号。如果能解决这些问题,将推动生物成像技术的进一步发展,也对相关的临床医学应用具有极其重要的意义。
创新研究
在本研究中,研究人员提出了一种新的基于反射模式的三维qpi方法,称为散斑衍射断层扫描(speckle diffraction tomography,sdt)。该方法能够量化多个散射样品中与深度相关的 ri 变化和结构动力学特征,同时提供衍射限制的横向分辨率和亚微米轴向分辨率(图一)。通过精确解决厚样品的逆散射问题,sdt 扩展了当前动态散斑qpi方法的成像深度, 这一进步使sdt能够对具有多重散射和像差的厚组织样本进行成像。sdt 考虑了时空相干和样本引起的像差,从而能够得到时空域反射场的四维 (4d) 点扩散函数 (point spread function,psf)(图二)。4d-psf 进一步使该方案能够逐层恢复样本的平均折射率,对于反射模式 qpi 系统来说这是不可能实现的。
研究人员使用 sdt 系统首先对厚度接近三个散射平均自由程的厚散射介质后面的红细胞进行成像。高灵敏度和高速成像能力使此方案能够量化红细胞膜波动(图四)。为了证明其在体内研究的可行性,研究人员对离体 sprague dawley (sd) 大鼠眼内的角膜结构进行了成像,横向分辨率约为 500 nm,轴向分辨率约为 1 µm,并描绘了每个角膜层的 ri 值。使用此方案,相距 4 μm 的 dua 膜和 descemet 膜的表面轮廓都能够得到清晰解析,并且能够以纳米级灵敏度绘制它们的轮廓(图四)。
这一研究突破了现有qpi成像技术的瓶颈,对于生物成像与临床医学应用具有极其重要的作用,具有极高的学术与应用价值。
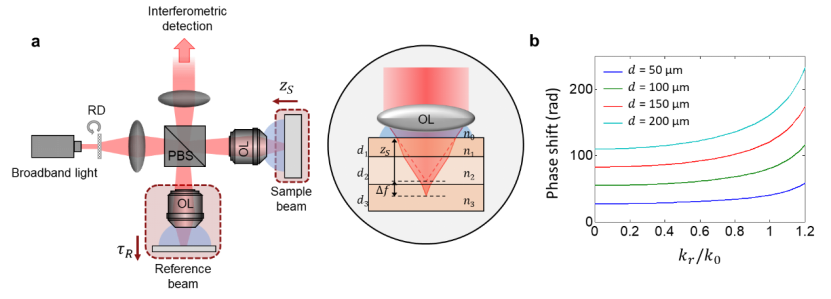
图一:厚样品成像的 sdt 原理图解。(a)sdt系统示意图。rd:旋转扩散器;pbs:偏振分束器;ol:物镜。zs表示样品顶面的轴向位置。τr 是参考波的到达时间,可以通过同时移动参考物镜-反射镜组件来调整。相应的箭头表示 zs 和 τr 的正值方向。 右侧显示了厚多层样品内ri失配引起的焦点偏移 δf。(b)单层中产生的相移关于归一化后的横向动量的函数的图示。图中绘制了不同层厚度(50μm、100μm、150μm 和 200μm)的相移曲线。
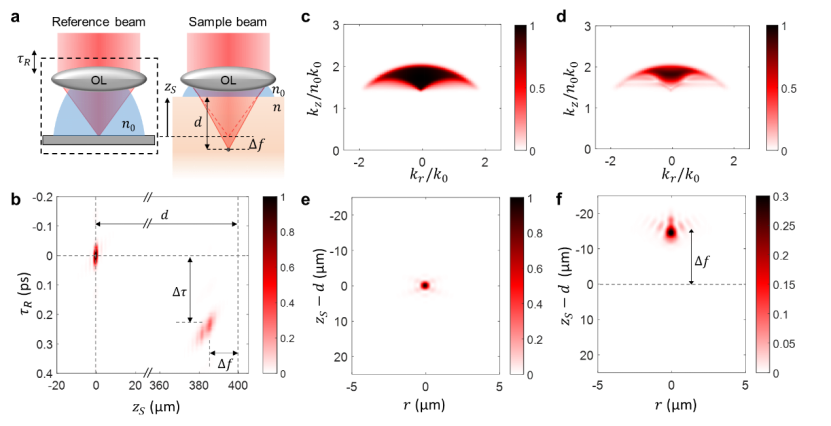
图二:使用sdt模型对psf和otf进行数值模拟。(a)数值模拟研究的测量方案示意图。点散射体位于单层介质内深度 d 处,平均 ri 值为 1.37。由于焦点偏移,通过将样本向上移动到轴向位置 zs 来使点散射体聚焦。 (b)位于 d = 0 和 400 µm 处的点散射体的点扩散函数。(c),(d)k 空间中点散射体位于 d = 0 μm 和 400 μm 且 τr = 0 和 230 fs 时的系统光学传递函数的幅度。(e),(f)实空间中的点扩散函数,通过分别对(c)和(d)中所示的光学传递函数进行傅里叶逆变换获得。
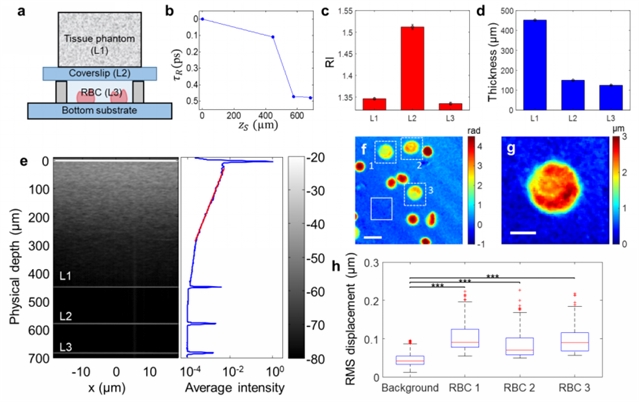
图三:散射组织模型底部红细胞的定量相位成像。 (a)由三层组成的组装样品的示意图:散射组织模型层(l1)、盖玻片层(l2)和悬浮红细胞的缓冲溶液层(l3)。 (b)与样本层 l1、l2 和 l3 相关的四个界面在 (zs,τr) 空间中的 psf 位置。(c)-(d)检索的三层的 ri 值和厚度。(e)根据 (b) 中所示的 (zs,τr)关系进行参考路径长度校正的样品的归一化强度横截面图像(左)和平均强度横截面曲线(右)。(f)l3 层底部界面红细胞的定量相图。 比例尺:10 µm。(g)rbc 1 的高度图,如 (f) 所示。比例尺:4 µm。(h),(f)(白色虚线框)和背景(白色实线框)中标记的三个红细胞的 rms位移。每个框中的红线代表中位数,而框的下边界和上边界表示第一和第三四分位数。虚线两端代表1.5个四分位数范围。红色标记代表超出 1.5 个四分位数范围的异常值。两个样本 t 检验表明,三个红细胞的 rms 位移与背景之间存在统计显着差异 (***p<0.001)。
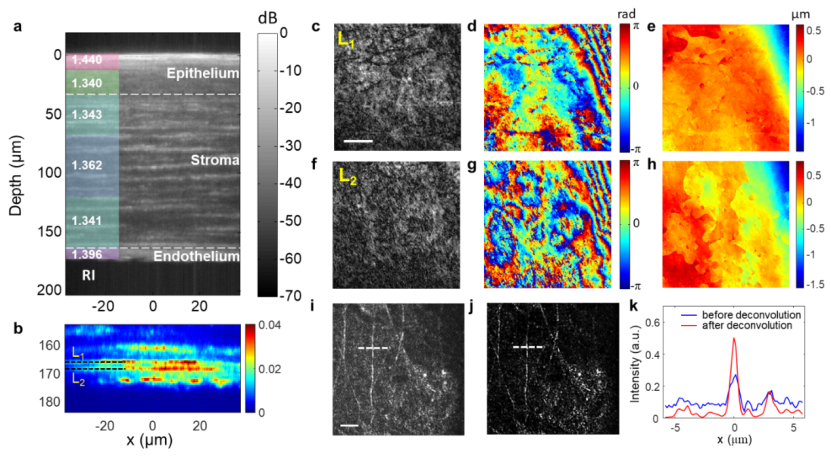
图四:固定sd大鼠角膜组织的体成像。(a)大鼠角膜组织的截面强度图像,具有对数刻度颜色映射(单位为 db)。左侧显示各层的平均 ri 值。(b)深度为 155 至 185 µm 的放大图像,具有线性刻度颜色映射。与 dua 膜和 descemet 膜相关的两个不同层被清楚地识别并分别标记为 l1 和 l2。 (c)-(h)l1 层和 l2 层的幅度、相位和高度图。比例尺:10 µm。(i)-(j),分别是 3d 反卷积之前和之后深度 d=133 µm 处的振幅图像。比例尺:10 µm。(k),沿 (i)-(j) 中白色虚线的横截面。蓝线:3d反卷积之前;红线:3d 反卷积后。
该文章发表在国际顶尖学术期刊《light: science & applications》,题为“mapping nanoscale topographic features in thick tissues with speckle diffraction tomography”,sungsam kang为论文的第一作者,renjie zhou和zahid yaqoob为本文的共同通讯作者。(来源:lightscienceapplications微信公众号)
相关论文信息:
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负yabo亚博88的版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。